L’essai clinique en un coup d’œil
L’étude STAR (STAR : Stimulation Therapy for Apnea Reduction) a été menée dans 22 institutions médicales de premier plan aux États-Unis et en Europe. Les résultats de l’étude STAR ont été publiés dans le New England Journal of Medicine du 9 janvier 2014.1
Les résultats montrent que les patients bénéficiant de la thérapie Inspire ont eu beaucoup moins d’épisodes d’apnée — ils ont également connu une amélioration de leur qualité de vie. Le taux de complications graves a été inférieur à deux pour cent.1
Les résultats à long terme publiés entre-temps montrent que les améliorations signalées après 12 mois sont également constantes après 36 mois et 60 mois. Ces améliorations sont les suivantes :1-3
- Une réduction de 78 % des événements d’apnée-hypopnée (voir figure 1).
- Une réduction de 80 % des épisodes de désaturation en O2 (voir figure 2).
- Une amélioration cliniquement significative et normalisée de la qualité de vie liée au sommeil, y compris de la somnolence diurne et de l’activité diurne, mesurée par l’échelle de somnolence d’Epworth (ESS — Epworth Sleepiness Scale, voir figure 3) et le questionnaire sur les résultats fonctionnels du sommeil (FOSQ — Functional Outcomes of Sleep Questionnaire, voir figure 4), respectivement.
- Une augmentation de la proportion de partenaires de lit déclarant aucun ronflement ou des ronflements légers, qui est passée de 17 % avant le traitement à 80 % (voir figure 5).
- Une forte observance du traitement (voir figure 6)
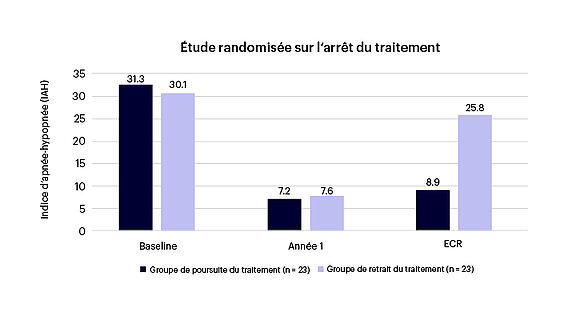
Dans le cadre d’un essai contrôlé randomisé portant sur l’arrêt du traitement, 46 répondeurs de l’étude STAR ont été répartis en deux groupes entre le 12e et le 18e mois. Au cours de l’essai randomisé, les patients du groupe d’arrêt du traitement ont présenté une aggravation de l’IAH ou de l’IDO ainsi qu’une détérioration de la qualité de vie. Les valeurs correspondaient aux valeurs à l’inclusion, avant le début du traitement.4
Les patients du groupe ayant poursuivi le traitement, en revanche, n’ont connu aucun changement pendant la période d’observation (voir figure 7). Au bout de 18 mois, les deux groupes ont de nouveau enregistré des succès thérapeutiques constants, subjectifs et objectifs. Les détériorations observées dans le groupe ayant arrêté la thérapie peuvent donc être directement attribuées à l’arrêt de la thérapie Inspire.4
Figure 1 : Diminution significative des épisodes d’apnée-hypopnée1-3
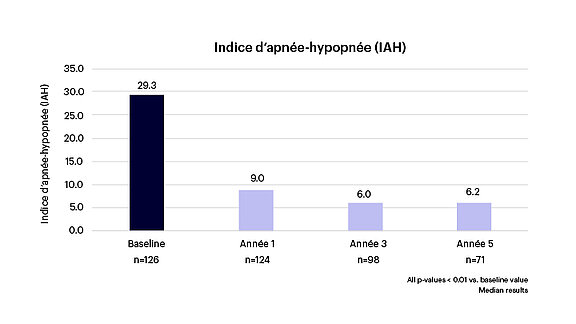
Figure 2 : Diminution significative des épisodes de désaturation en O21-3
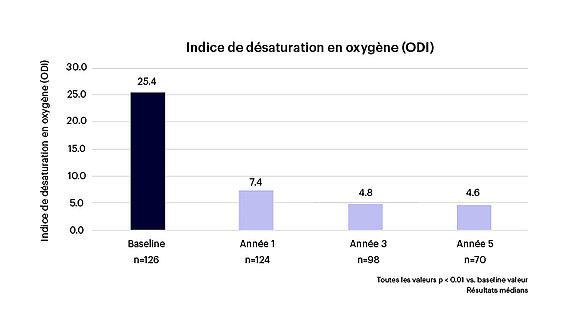
Figure 3 : Amélioration significative de l’activité quotidienne1-3
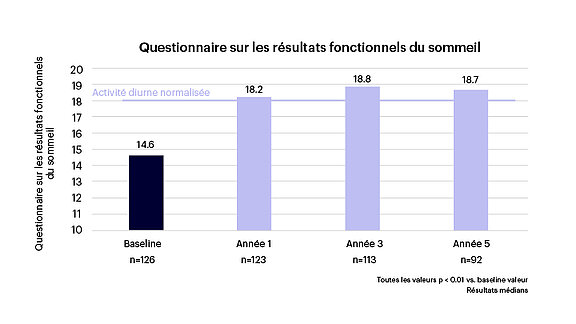
Figure 4 : Amélioration significative de la somnolence diurne1-3
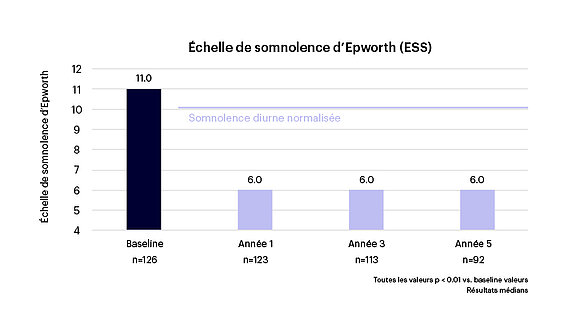
Figure 5 : Le partenaire de lit a signalé des ronflements1-3
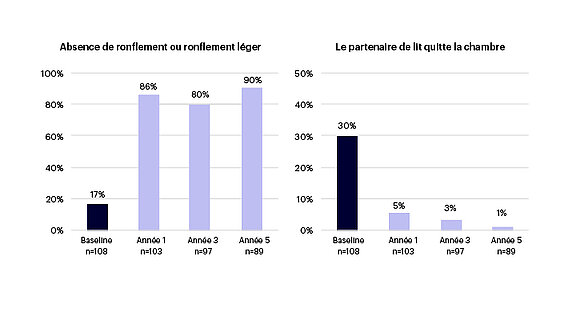
Figure 6 : Observance du traitement rapportée par le patient1-3
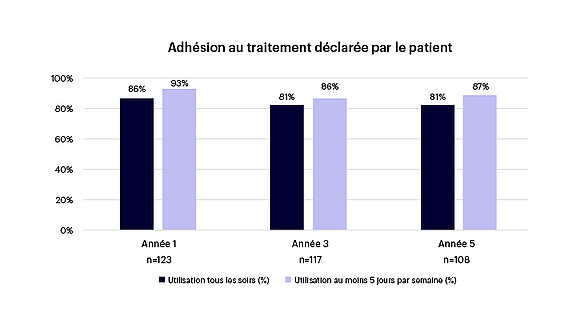
Figure 7 : Confirmation de l’effet thérapeutique4
- Strollo Jr, Patrick J., et al. Upper-airway stimulation for obstructive sleep apnea. New England Journal of Medicine 370.2 (2014): 139-149.
- Woodson, B. Tucker, et al. Three-year outcomes of cranial nerve stimulation for obstructive sleep apnea: the STAR trial. Otolaryngology–Head and Neck Surgery 154.1 (2016): 181-188.
- Woodson, B. Tucker, et al. "Upper Airway Stimulation for Obstructive Sleep Apnea: 5-Year Outcomes." Otolaryngology–Head and Neck Surgery (2018): 0194599818762383.
- Woodson, B. Tucker, et al. Randomized controlled withdrawal study of upper airway stimulation on OSA: short-and long-term effect. Otolaryngology–Head and Neck Surgery 151.5 (2014): 880-887.
Données sur l’observance : données de l’étude STAR
La dénomination ou la référence commerciale du dispositif médical
Inspire® IV UAS (Générateur d’impulsions implantable (IPG) Inspire IV, modèle 3028 ; Électrode de stimulation, modèle 4063 ; Électrode de détection respiratoire, modèle 4340), (Reference: 200-276-010 FR Rev D Sys Implant Man EU only eLABEL.pdf)
La destination attribuée au dispositif médical par son fabricant et pour laquelle la publicité est diffusée, ainsi que les caractéristiques et les performances revendiquées au titre de cette destination
Usage prévu : La thérapie par stimulation des voies respiratoires supérieures d’Inspire a été prévue pour traiter l’apnée obstructive du sommeil modérée à sévère (15 ≤ IAH ≤ 65) en améliorant la perméabilité respiratoire par la stimulation du nerf hypoglosse, synchrone avec la respiration, afin de provoquer une réponse neuromusculaire à la base de la langue (Reference: 200-276-010 FR Rev D Sys Implant Man EU only eLABEL.pdf, p. 7)
La classe du dispositif médical
Class III
Le cas échéant, le nom de l'organisme habilité qui a établi l'évaluation de conformité
BSI, a Notified Body for the Directive 90/385/ECC on Active Implantable Medical Devices, Annex 2, Section 4 (Notified Body Number 2797). CE 562872 (Reference: CE 562872 05-24-2021 Expires 26 May 2024.pdf)
Le nom du fabricant du dispositif médical ou de son mandataire
Inspire Medical Systems, Inc.
Les informations indispensables pour un bon usage du dispositif médical
Manuel d'implantation IFU (Reference: 200-276-010 FR Rev D Sys Implant Man EU only eLABEL.pdf, p. 20ff)
Une invitation expresse à lire attentivement les instructions figurant dans la notice qui accompagne le dispositif médical ou sur l'étiquetage remis au professionnel de santé
Veuillez lire attentivement ce manuel avant de l'utiliser. Il fournit des instructions pour la manipulation, le stockage et l'implantation des sondes et du générateur. Il contient également des informations importantes sur le traitement à discuter avec votre patient et des instructions pour les soins de suivi. (Reference: 200-276-010 FR Rev D Sys Implant Man EU only eLABEL.pdf, p. 8)
La situation du dispositif médical au regard du remboursement par les organismes d'assurance maladie et, le cas échéant, les conditions de prescription et d'utilisation auxquelles a été subordonnée son inscription sur la liste mentionnée à l'article L. 165-1 du code de la sécurité sociale, pour la destination faisant l'objet de la publicité
Indications retenues: Traitement du syndrome d’apnée-hypopnée obstructive du sommeil (SAHOS) modéré à sévère (15 ≤ IAH ≤ 50) chez les patients avec un IMC inférieur à 32 kg/m² et en échec de traitement (non répondeurs ou non-observants) par pression positive continue (PPC) et par orthèse d’avan-cée mandibulaire (OAM) dans les indications définies par la LPPR.
Le cas échéant, le numéro interne de référencement
801-051-008 Rev. A
État: Août 2023
Le syteme Inspire® est un dispositif médical. Traitement du syndrome d’apnée-hypopnée obstructive du sommeil (SAHOS) modéré à sévère chez les patients en échec de PPC (pression positive continue).

